O termo instabilidade de microsatélites (do inglês microsatellites instability) ou simplesmente MSI, refere-se a um via oncogenética que pode ser pesquisada e caracterizada, e pode estar relacionada a uma síndrome familiar chamada síndrome de Lynch. Historicamente a pesquisa desta via tem maior importância para os casos de câncer colo-retal (CCR). Porém essa pesquisa também tem sido feita para outros tipos de tumores (como ovário e endométrio).
Na verdade, a instabilidade de microsatélites é uma consequência de um desarranjo molecular em algumas enzimas reparadoras do DNA (missmatch repair – MMR). Para entendermos melhor essa via é necessário definirmos o que são os microsatélites.
MICROSATÉLITES
Microsatélites representam a repetição de 1 a 6 pares de base que não codificam protéina. Tomemos como exemplo a seguinte sequência hipotética de nuleotídeos:
CGTTCAATAAGCAAAAATCCATAGTTTTAGGAATGTGGGCTGCTTGGTGTGATGTAGAAGGCGCCAATGCATCTC
GACGTATGCGTATACGGGTTACCCCCTTTGCAATCAGTGCACACACACACACACACACACACACACACACAC
ACACACAGTGCCAAGCAAAAATAACGCCAAGCAGAACGAAGACGTTCTCGAGAACACCAGAAGTTCGTGCTGTC
GGGGCATGCGGCGAGTAAAGGGGAT
Em vermelho vemos a repetição da dupla de nucleotídeos CA. Estes são os microsatélites.
Durante muito tempo, por não sabermos a real função destas sequências repetitivas, as considerávamos como “Junk DNA”, ou seja DNA lixo. No entanto, indicam que os microsatélites estão envolvidos na regulação da expressão gênica. Por serem herdadas, a pesquisa dessas repetições são utilizadas também nos testes de identificação humana e paterninade.
Os microsatélites possuem a particularidade de serem predispostos a erros de replicação do DNA. Ou seja, quando existe algum defeito nessa fase da divisão celular, os microsatélites se comportam como uma região do DNA particularmente predisposta a sofrer modificações, a se tornarem instáveis.
INSTABILIDADE DE MICROSATÉLITES (MSI)
MSI representa pequenos aumentos ou diminuições no número dessas repetições de nucleotídeos e são decorrentes de defeitos no reparo do DNA. Quando identificamos que há MSI inferimos que os mecanismos de reparo do DNA estão defeituosos.
Esses erros de reparação predispõem à carcinogênese e portanto, ao identificarmos a MSI podemos definir uma via oncogenética própria, que terá implicações como veremos a frente.
BASE MOLECULAR PARA A MSI
Durante a replicação, o DNA está sujeito a defeitos pontuais, como troca de bases. Para tanto a natureza dispôs algumas enzimas que exercem o papel de varrer a fita de DNA replicada à procura desses defeitos. Entre várias que participam desse processo as que possuem maior importância clínica são: MLH1 MSH2 MSH6 PMS2. Essas enzimas não atuam de forma isolada, mas formando dímeros.
MutSa: MSH2 + MSH6 (Função: Deslizar pela fita de DNA a procura de erros. Quando os encontra, recruta o heterodímero MutLa).
MutLa: MLH1 + PMS2 (Coordena outras proteínas para atuar na reparação do DNA).
Resumindo até aqui…. a função inadequada das enzimas reparadoras de DNA acarreta em uma predisposição a erros na síntese desta molécula. A consequência disto é o aumento ou diminuição (na verdade, instabilidade) dos microsatélites além do acúmulo de predisposição a outros erros em genes que regulam o ciclo celular.
Para prosseguirmos no entendimento deste assunto, é necessário respondermos à seguinte pergunta: O que pode ter acontecido para que essas enzimas MMR perdessem sua função?
A resposta tem duas explicações, ou o defeito nessas enzimas foi herdado ou foi adquirido.
HERDADO Nestes casos o paciente portador do tumor com MSI recebeu de um dos seus pais o alelo mutado dos genes de uma das MMR. Quando o segundo alelo sofre uma alteração, o tecido afetado passa a não sintetizar mais essa enzima de MMR e o resultado disso já conhecemos. Essa é justamente a definição fisiopatológica da Síndrome de Lynch também conhecida como síndrome do câncer colo-retal hereditário não polipomatoso (HNPCC).
ADQUIRIDO Nesta forma, também chamada de esporádica, não há nada de errado com o material genético herdado. O problema está adiante. Ou houve uma inativação da expressão dessas enzimas (dos dois alelos) por um processo epigenético de metilação ou uma mutação somática/adiquirida aconteceu nos genes das enzimas MMR.
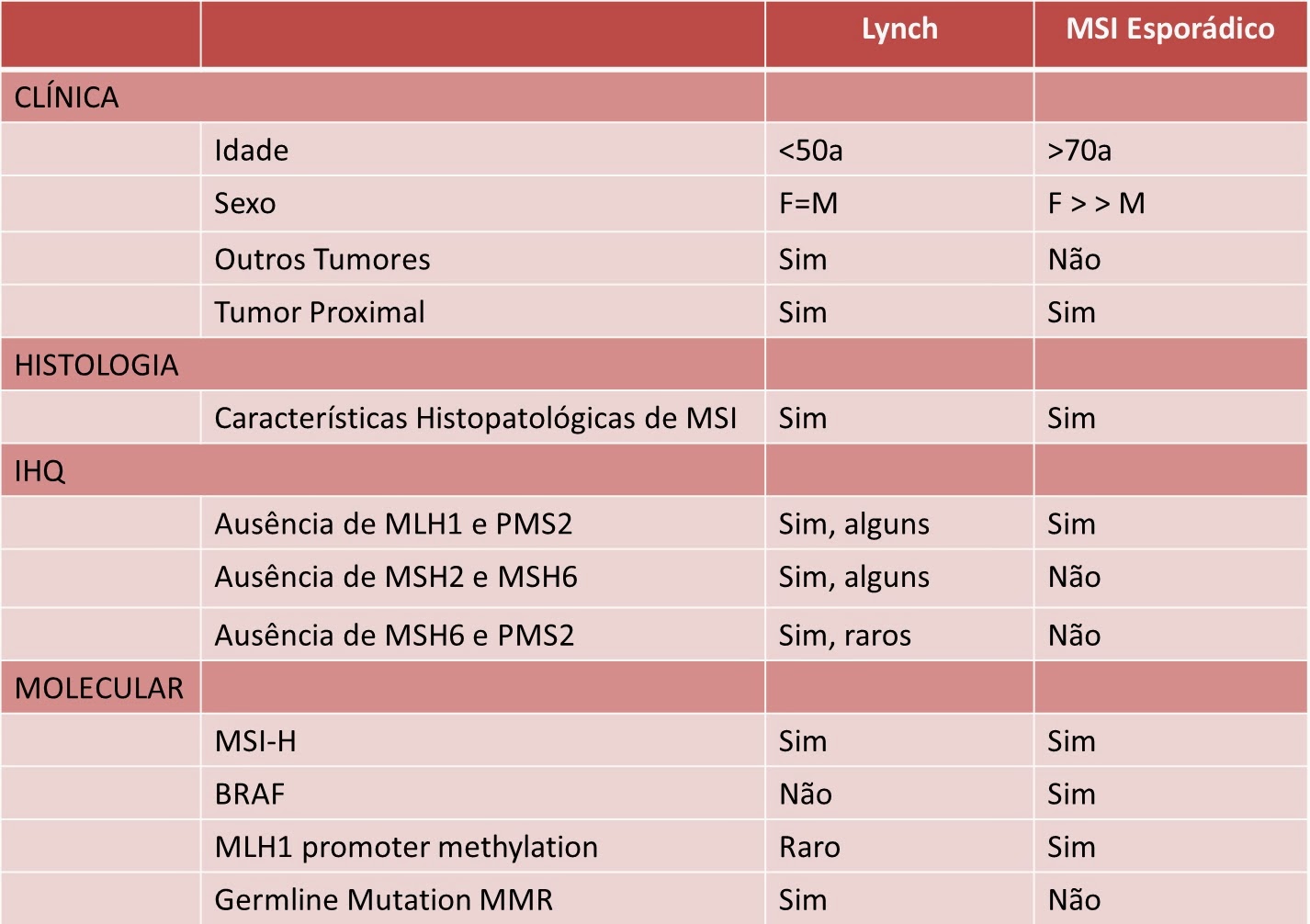
É interessante notar que, para os carcinoma coloretais, as duas formas de MSI (esporádica e no contexto da síndrome de Lynch) possuem características clínicas e moleculares distintas. Vejamos o seguinte quadro:
1) Os pacientes com síndrome de Lynch tendem a ser mais jovens, sem predominância de gênero. Já na forma esporádica são pacientes mais velhos com clara predominância feminina.
2) Quando observada a expressão por imunohistoquímica, na síndrome de Lynch pode acontecer todas as combinações biológicas das perdas das enzimas MMR. Já na forma esporádica só é vista a ausência de MLH1 e PMS2.
3) A mutação BRAF V600E está virtualmente ausente na síndrome de Lynch. Ao contrário, na forma esporádica vemos essa mutação em até metade dos casos.
Populacionalmente, se considerarmos todos casos de CCR, 15% deles apresentarão MSI, sendo 13% esporádicos (relacionados a metilação do MLH1) e 2% pertencentes à síndrome de Lynch.
COMO PESQUISAR MSI
Pudemos ver que esse é um assunto complexo, mas muito interessante. Para podermos aplicar esses conhecimentos na prática clínica é necessário uma abordagem escalonada em níveis de complexidade (e custos!) para garantirmos a melhor razão custo/benefício para o paciente.
É possível fazer a pesquisa dessa via em 3 formas:
Resumidamente temos que:
IHQ Identifica a expressão ou ausência de expressão no tecido tumoral de uma das 4 enzimas MMR.
PCR Faz a pesquisa propriamente dita dos microssatélites no DNA do tumor e nas células normais do paciente.
PESQUISA DE MUTAÇÃO É feito no sangue periférico (para os genes das enzimas MMR) a fim de determinar se o defeito foi herdado. No caso do BRAF a pesquisa é feita no tecido tumoral.
Vamos explorar cada uma destas técnicas.
IHQ
Usa da reação antígeno-anticorpo para revelar se determinado tecido expressa ou não uma das enzimas de MMR. Cada uma delas é pesquisada em separado. Segue um exemplo de adenocarcinomas coloretal submetido a essa pesquisa:
Vemos que este tumor não expressou MLH1 nem PMS2 (note núcleos azuis/negativos com controle interno positivo), sendo mantidas as demais enzimas.
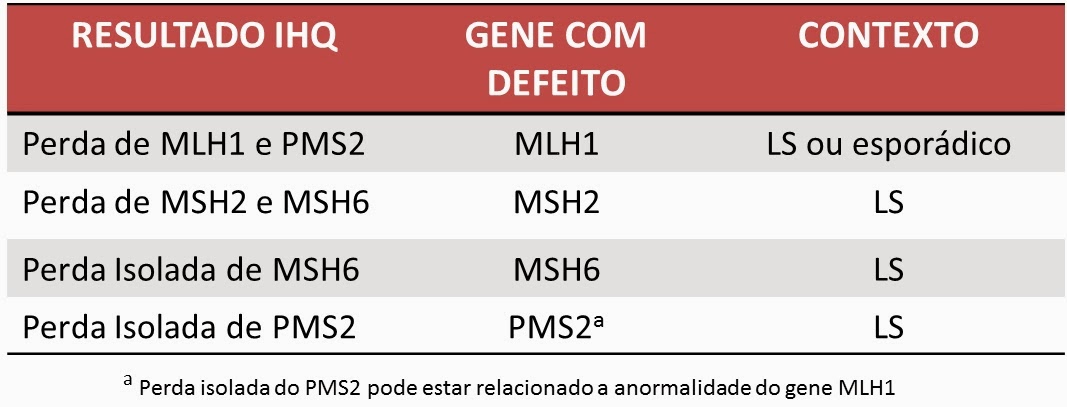
Tendo em mãos o resultado para cada enzima, é possível sabermos qual gene está defeituoso e se o contexto da alteração é de síndrome de Lynch ou esporádico.
Quando interpretamos a IHQ, é necessário certificarmos se há controle interno positivo na amostra (linfócitos, células epiteliais não neoplásicas). Só devemos considerar a não expressão de uma das enzimas caso no mesmo corte haja controle positivo, certificando a reação.
Quando há expressão da enzima pelo tecido tumoral usamos o termo PROFICIÊNCIA ou pMMR. Ou seja, classificamos o tumor como proficiente (pMMR) na expressão das MMR. Quando não há expressão da enzima usamos o termo DEFICIÊNCIA ou dMMR, sendo o tumor classificado como deficiente (dMMR) na expressão das MMR.
A IHQ é o menos complexo dos métodos e portanto escolhido para se fazer a triagem dos casos. Hoje já se recomenda que todos os CCR, carcinomas de endométrio e ovário sejam testados para as enzimas.
PCR
Compara os microsatélites do tumor com os de tecido não tumoral do mesmo paciente. O resultado fica assim:
Neste exemplo têm-se que no tecido tumoral há um padrão anormal de distribuição e tamanho de microsatélites.
Para garantir melhor precisão, este teste é feito em 5 loci padronizados, o chamado Painel Bethesda a saber: BAT25, BAT26, D5S346, D2S123 e D13S250.
Depois de testados nestes 5 loci, o tumor poderá ser classificado como MSI-H (high), MSI-L (low) ou MSS (stable)
MSI-H Instabilidade em 2 ou + dos loci pesquisados
MSI-L Instabilidade em 1 dos loci pesquisados
MSS Ausência de instabilidade
PESQUISA DE MUTAÇÃO
Nesse teste, colhem-se células normais do indivíduo (por exemplo colhidas pelo esfregaço bucal) que são acondicionadas em líquidos preservadores do material genético. Com as técnicas mais modernas, chamadas Next Generation Sequencing, é possível em um mesmo momento e com uma amostra fazer a pesquisa de mutações para várias genes. O encontro de mutações das enzimas MMR em células não tumorais é base fisiopatológica definidora da síndrome de Lynch.
EM RESUMO
Os termos deficiente na expressão das enzimas reparadoras (dMMR) e MSI-H apesar de se referirem à mesma via patogenética, não podem ser encaradas como sinonimos, pois são resultados de métodos diagnósticos diferentes. Os termos de classificação usados neste contexto podem ser resumidos da seguinte maneira:
Proficiência na expressão de enzimas de reparo de DNA (pMMR): Significa que o tecido foi testado por imunohistiquímica e verificado expressão mantida das enzimas pesquisadas.
Deficiência na expressão de enzimas de reparo de DNA (dMMR): Significa que o tecido foi testado por imunohistiquímica e verificado ausência de expressão em pelo menos uma das enzimas pesquisadas.
Instabilidade de Microsatélites (MSI) Significa que o tumor foi testado molecularmente e verificado instabilidade de microsatélites. MSH-H se refere a tumores com alteração em 2 ou + dos loci pesquisados. MSI-L se refere a instabilidade em 1 dos loci pesquisados.
Estabilidade de Microsatélites (MSS) Significa que o tumor foi testado molecularmente, não sendo achada instabilidade de microsatélites em nenhum dos loci examinados.
Dessa maneira, para classificar os tumores que possuem alterações da via dos microsatélites, podemos usar tanto a imunohistoquímica como métodos moleculares. Em vários estudos clínicos que testaram eficácia de tratamentos para esse grupo especial de tumores, os pacientes são selecionados ou por imunohistoquímica (dMMR) ou por métodos moleculares (MSI-H) . No entanto a correlação desses métodos não é perfeita. Em casos raros, podemos ter uma mutação do tipo missense (especialmente em MLH1) em que a protéina é expressa, possui antigenicidade, mas é disfuncional. Esses casos vão fornecer resultados contraditórios ou seja, o mesmo tumor poderá ser classificado como pMMR e MSI-H.
CONDUTAS A PARTIR DO LAUDO DE IHQ
A depender das enzimas com deficiência, o caso deverá ser conduzido da seguinte maneira:
Deficiência de MLH1 + PMS2: Esse imunofenótipo pode ser observado em casos de mutações germinativas (síndrome de Lynch) ou esporádicas (metilação do promoter do MLH1). A pesquisa da mutação BRAF V600E é indicada nesses casos melhor classificação: caso seja identificada essa mutação, o tumor é entendido como esporádico. Outra alternativa é a pesquisa direta da metilação do promoter do MLH1 que também caracteriza o tumor como esporádico. A ausência de mutação BRAF V600E e de metilação do promoter do MLH1 sugere fortemente a possibilidade de síndrome de Lynch, estando indicado a pesquisa de mutação em MLH1.
Deficiência de MSH2 + MSH6: Indica alta probabilidade de síndrome de Lynch, com mutação germinativa da enzima MSH2. Portanto, para caracterizar Lynch recomenda-se pesquisa de mutação em MSH2.
Deficiência de MSH6: Indica alta probabilidade de síndrome de Lynch, com mutação germinativa da enzima MSH6. Portanto, para caracterizar Lynch recomenda-se pesquisa de mutação em MSH6.
Deficiência de PMS2: Indica alta probabilidade de síndrome de Lynch, com mutação germinativa da enzima PMS2. Portanto, para caracterizar Lynch recomenda-se pesquisa de mutação em PMS2.









Boa noite, meu nome é Marilene Jose da Silva, eu gostaria de saber qual é o caso indicado para a imunoterapia. as proteínas devem ser esporádicas e quais ? Fiz na imuno-histoquímica. deu positivo para instabilidade.
Marilene boa noite. Infelizmente com os poucos dados que você pode compartilhar nesse canal, não conseguimos orientar muito. O fato do seu tumor ter sido caracterizado como “positivo para instabilidade” irá orientar seu oncologista e cirurgião na melhor terapia. Boa sorte no tratamento.