O laudo anatomopatológico de peças cirúrgicas que contêm câncer colorretal (CCR) fornecem informações prognósticas que determinarão a conduta do paciente. Em primeiro lugar, o exame anatomopatológico confirma o diagnóstico de cancer, fornecendo o tipo histológico e sua gradação. A segunda informação importante é o estadiamento que representa a extensão do tumor na peça examinada. Além desses, o laudo traz outros dados que podem ser determinantes para orientar próximas condutas oncológicas e cirúrgicas.
TIPO HISTOLÓGICO
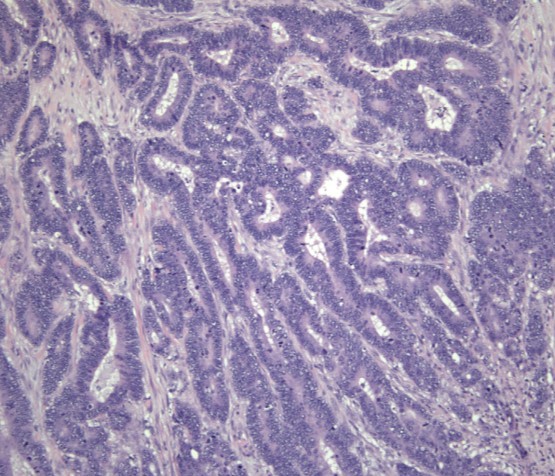
A Organização Mundial de Saúde (OMS) reconhece vários subtipos histológicos de carcinomas coloretais, sendo o mais comum o adenocarcinoma com diferenciação intestinal, sem outras especificações (SOE).
Adenocarcinoma, sem outras especificações (SOE). Os Adenocarcinomas, SOE possuem diferenciação intestinal e são tipicamente compostos por glândulas grandes, anguladas revestidas por células de núcleos ovóides com cromatina grosseira, numerosas mitoses, necrose com debri celular e associados à estroma desmoplásico.
Gradação: Para os casos de adenocarcinoma SOE, a OMS demanda que a neoplasia seja graduada com base na porcentagem de formação glandular, medida no componente de maior grau:
G1 (Bem diferenciado): >95% de formação glandular
G2 (Moderadamente diferenciado): 50-95% de formação glandular
G3 (Pouco diferenciado): <50% de formação glandular
G4 (Indiferenciado): Sem formação glandular, mucossecreção, diferenciação escamosa e/ou neuroendócrina.
O grau histológico, especificamente para os adenocarcinomas SOE pouco diferenciados possuem forte correlação com prognóstico adverso.
Subtipos histológicos. Os subtipos histológicos não devem ser graduados. A tabela abaixo contém os principais subtipos histológicos e suas características clinico-patológicas:
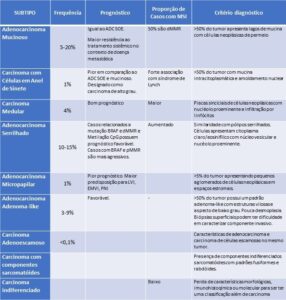
dMMR: Deficiência na expressão das enzimas reparadoras do DNA (via da instabilidade de microssatélites); LVI: Invasão linfovascular; EMVI: Invasão venosa extra-mural; PNI: Invasão perineural
ESTADIAMENTO
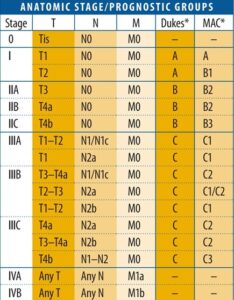
O estadiamento reflete a extensão do tumor, e seu principal objetivo é fornecer informações prognósticas úteis para a decisão do melhor tratamento, estratificando em grupos casos com comportamento prognóstico e terapêutica semelhantes. A 8ª edição da AJCC faz o estadiamento baseado no sistema TNM (T – tumor; N – linfonodo; M – metástase). O componente (T), do estadiamento do TNM do CCR, é dependente comprometimento das camadas da parede intestinal conforme abaixo:
TX Tumor primário não pode ser avaliado
T0 Sem evidência de tumor primário
Tis Carcinoma in situ: intraepitelial ou com invasão da lâmina própria
T1 Tumor invade submucosa
T2 Tumor invade muscular própria
T3 Tumor invade tecidos pericólicos
T4a Tumor penetra a superfície do peritoneo visceral
T4b Tumor invade diretamente ou está aderido a outros órgãos / estruturas
Ao se juntar as informações T com N (comprometimento de linfonodos) e M (metástases), temos a definição dos Estágios conforme abaixo:
O estadiamento do CCR, juntamente com demais dados presentes no laudo são são importantes para definir o prognóstico de cada caso e consequentemente na indicação de terapia adjuvante. Como regra geral temos:
1) O estágio I (pT2N0 ou <) possui baixa probabilidade de progressão de doença e portando baixa tendência a benefício com tratamento adjuvante.
2) O estágio IIA (pT3N0) possui uma imprevisibilidade com relação à progressão de doença, a decisão quanto a indicação de terapia adjuvante varia caso a caso sendo dependente da avaliação de outros fatores de risco.
3) Os estágios IIB a IVB (pT4aN0 ou>) possuem uma alta probabilidade de progressão de doença e portanto teriam maior benefício com o tratamento adjuvante.
Como pode-se ver, a definição de pT3 vs pT4 implica em mudanças de estágio clínico, influenciando nas decisões para terapia adjuvante. Apesar de parecer fácil essa diferenciação (pT3 vs pT4), algumas situações trazem dificuldades práticas, que serão discutidas abaixo.
DIFICULDADES NO ESTADIAMENTO (T): pT3 vs pT4
Como já descrito acima, a diferenciação pT3 vs pT4 é importante pois os casos pT4 são fortes candidatos a terapia adjuvante. No entanto, a literatura mostra que nem todos os casos pT3 são iguais, sendo possível identificar alguns com alto risco de progressão de doença, especificamente aqueles que chegam a 1,0mm ou menos da superfície da serosa (chamaremos esses casos a partir de agora como pT3+).
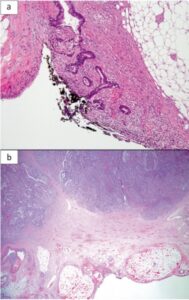
(a) CCR pT4: neoplasia alcança e perfura a superfície serosa. (b) CCR pT3: Neoplasia envolve tecidos pericólicos mas não compromete a superfície serosa (1).
Como os casos pT3+ comportam?
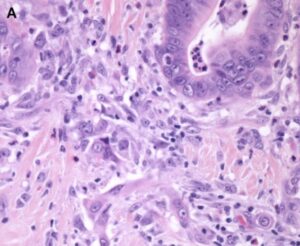
Panarelli e cols (2) verificaram que a frequência de carcinomatose peritoneal para os casos pT3 é de 3%, e 18% para os casos pT4a. Entre aqueles casos pT3 com menos de 1,0mm da serosa (pT3+), a freqüência de carcinomatose peritoneal foi de 11%, muito mais próxima dos casos pT4a. No mesmo estudo, os investigadores conseguiram isolar células neoplásicas na superfície da peça cirúrgica em 55% dos casos pT4a, 19% dos casos pT3 e em nenhum caso pT1/pT2. Dos casos pT3 com células neoplásicas na superfície, todos eram pT3+.
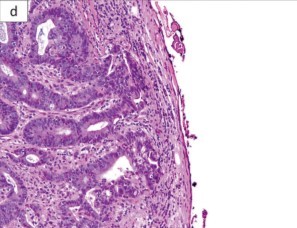
Exemplo de CCR pT3 com menos de 1,0mm da superfície serosa (pT3+). (2)
Diante desse cenário, seria prudente executar cortes seriados quando se estiver diante de um caso pT3+ para se tentar caracterizar eventual invasão da serosa (pT4). Uma alternativa, caso não se caracterize o estadiamento pT4, seria adicionar uma nota ao laudo esclarecendo o pior prognóstico esperado.
DIFICULDADES NO ESTADIAMENTO (N): Depósitos Tumorais (Tumor Deposits – TD / pN1c)
TD referem-se a focos de neoplasia na gordura pericólica e periretal, ou no mesentério adjacente, dentro da área de drenagem linfática do tumor, na ausência de tecido linfonodal neural ou vascular associados. TD não representam linfonodos comprometidos, mas são entendidos como metástase-em- trânsito, via vasos linfáticos, do tumor em sentido aos linfonodos. Se as células neoplásicas estiverem associadas a parênquima de linfonodo o foco é definido como metástase linfonodal, e não TD. Da mesma forma, se uma parede vascular ou estrutura neural puder ser observada junto aos focos neoplásicos, as lesões devem ser classificadas como invasão vascular ou perineural respectivamente.
A sigla N1c deve ser usada quando se observam TD, na ausência de qualquer linfonodo comprometido, independente da categoria T. Definido dessa maneira, TD se comportam como fator prognóstico adverso, e terapia adjuvante deverá ser considerada (3).
DIFICULDADES NO ESTADIAMENTO (N): Número mínimo de linfonodos
Para se estadiar satisfatoriamente o CCR, definiu-se como 12 o número mínimo de linfonodos que devem ser isolados e estudados. Esse número foi obtido através de estudos que demonstraram que quanto mais linfonodos são isolados, maior a chance de descobrir metástases. Hoje várias entidades (AJCC, ACS, NQF) assumem como consenso o mínimo de 12 linfonodos que devem ser isolados em peças cirúrgicas de CCR.
Na prática, muitas vezes não é possível isolar 12 linfonodos em peças cirúrgicas de CCR, mesmo depois de uma dissecação diligente. Alguns fatores conhecidos que podem afetar o número de linfonodos isolados:
- Quimio / Radioterapia Neoadjuvante: O uso pré-operatório de quimio e radioterapia desencadeia mudanças imunológicas, com redução de linfócitos CD4, além de redução do número e tamanho de linfonodos, o que torna mais difícil sua dissecação macroscópica. Alguns estudos têm demonstrado que o fato de serem isolados menos de 12 linfonodos na verdade seria uma consequência de maior sensibilidade individual à terapia aplicada, e que esses casos teriam maior proporção de resposta patológica completa.
- Topografia: Existe uma tendência a serem dissecados um número maior de linfonodos em tumores localizados no cólon do que aqueles localizados no reto. Isso ocorre pelo fato dos linfonodos do mesocólon serem maiores que do mesorreto, facilitando sua dissecação. Além disso, peças cirúrgicas resultantes de ressecção de tumores no cólon costumam ser maiores que as de tumores retais, dessa maneira, o leito de linfonodos amostrados em peças colônicas tendem a ser maior.
- Variações Fisiológicas: Algumas variações nas características dos pacientes podem estar relacionadas ao número de linfonodos dissecados. Maior idade, imunodeficiências e obesidade são fatores relacionados a menor número de linfonodos dissecados. Além disso variações anatômicas podem influenciar nesse número.
Dessa maneira o número de linfonodos dissecados deve ser interpretado individualmente. Caso o paciente tenha sido submetido a terapia neoadjuvante, o menor número de linfonodos dissecados pode até mesmo ser entendido como um marcador de resposta terapêutica.
TUMOR BUDDING (TB)
TB é definido como a presença de células infiltrantes de maneira isolada ou formando agrupamentos de até 4 células no limite invasivo do tumor. As células podem ter morfologia alongada, fusiforme, que se misturam com o estroma, um fenomeno chamado de transformação epitelial-mesenquimal. O TB é o resultado da perda de junções intercelulares, e seria evidência de pouca diferenciação da neoplasia.
A presença de TB foi demonstrada como fator de risco para metástases e maior mortalidade. A avaliação de TB deve ser feita em pelo menos 10 campos de grande aumento e o resultado avaliado em número de células ou agregados por 0,785mm2. A quantide de células ou agregados por 0,785 mm2 permite separar o TB em graus. (4)
INVASÃO VASCULAR (LINFOVASCULAR E DE PEQUENOS VASOS)
A invasão linfovascular e de pequenos vasos (LVI) é fator de pior prognóstico em CCR. O critério para se caracterizar LVI é a identificação de êmbolos tumorais em espaços vasculares pequenos revestidos por endotélio, melhor apreciado na periferia do tumor, sem a presença de uma camada de músulo liso ou lâmina elástica. O termo “pequenos vasos” refere-se a linfáticos, capilares e vênulas pós-capilares. A presença de parede vascular caracteriza a invasão como de grandes vasos.
INVASÃO VASCULAR (GRANDES VEIAS)
A invasão vascular de grandes veias se comporta como um fator independente de mal prognóstico. Ela pode ser extramural (além da muscular própria) ou intramural (submucosa e muscular própria). Uma vez que a invasão vascular pode levar à destruição da veia, colorações especiais como ELASTICO ajudam a demonstrar a parede da estrutura vascular comprometida. A invasão de grandes veias, especialmente extramurais, é entendido como fator prognóstico independente para risco de metástases hepáticas.
INVASÃO PERINEURAL
A invasão perineural (PNI) está presente em até 10% dos CCR, particularmente naqueles com critérios de alto risco, estando associado a metástases para linfonodos e recorrência.
MARGENS CIRÚRGICAS
Margens cirúrgicas de espécimes que contenham CCR referem-se à superfície da peça em que houve a separação pelo cirurgião da peça cirúrgica propriamente dita daqueles tecidos que permaneceram no paciente. Por essa definição, a superfície serosa (peritoneo visceral) não constitui uma margem cirúrgica.
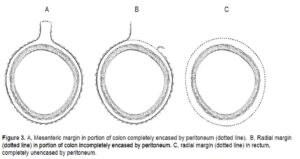
As margens proximal e distal referem-se aos limites do tubo intestinal em que foi feita a ressecção. A margem radial representa os tecidos que foram ressecados pelo cirurgião mais próximos à penetração máxima do tumor e variam conforme a topografia do tumor.
Uma vez que o 1/3 inferior do reto é inteiramente extraperitoneal, a margem radial se extende circunferencialmente e é referida como margem circunferencial. Análises multivariadas indicam que o envolvimento da margem radial é o fator mais crítico na predição de recorrência local em tumores retais. A margem radial é considerada positiva se o tumor chega a 1,0mm ou menos da superfície.
AVALIAÇÃO DE RESPOSTA À TERAPIA NEOADJUVANTE
A terapia neoadjuvante é uma opção para tratamento de carcinomas localmente avançados do reto médio e inferior. O exame anatomopatológico desses espécimes geralmente demonstra regressão tumoral com pequenos focos de carcinoma viável. Neoplasias que demonstraram forte resposta terapêutica possuem associação com sobrevida livre de doença. Existem vários métodos de graduação da resposta terapêutica, o sistema recomendado pelo Colégio Americano de Patologistas (CAP) é o Modified Ryan Scheme for Tumor Regression Score, conforme abaixo:
(0) Resposta completa (Ausência de células tumorais viáveis)
(1) Resposta quase completa (Células isoladas ou em pequenos grupos
(2) Resposta parcial (Câncer residual com regressão tumoral evidente, maior que células isoladas ou em pequenos grupos
(3) Ausência / Pouca Resposta (Tumor residual extenso, sem sinal de regressão tumoral)
Bibliografia
- Robert Pantaleon Vasquez, Mustafa Erdem Arslan, Hwajeong Lee, Tonya S King, Deepti Dhall, Dipti M Karamchandani. T3 versus T4a staging challenges in deeply invasive colonic adenocarcinomas and correlation with clinical outcomes. Mod Pathol. 34, 2021 , Vols. (1):131-140.
- Nicole C Panarelli, Andrew M Schreiner, Suzanne M Brandt, Neil A Shepherd, Rhonda K Yantiss. Histologic features and cytologic techniques that aid pathologic stage assessment of colonic adenocarcinoma. Am J Surg Pathol. 37, 2013 , Vols. (8):1252-8.
- Lawrence J. Burgart, Sanjay Kakar, Chanjuan Shi,. Protocol for the Examination of Resection Specimens From Patients With Primary Carcinoma of the Colon and Rectum. Disponível em: cap.org, 2020.
- Melanie Johncilla, Rhonda K. Yantiss. Histology of Colorectal Carcinoma Proven and Purported Prognostic Factors. Surg Pathol Clin. 13, 2020 , Vols. (3):503-520.