COMO ENVIAR MATERIAL PARA PESQUISA DE BIA-ALCL PARA O LABORATÓRIO DE CITOPATOLOGIA
Antes de iniciarmos este post, vamos fornecer informações de como o médico que colheu a amostra deve encaminha-la ao laboratório. As instruções abaixo se aplicam a punção de líquido /seroma periprótese.
- O líquido aspirado deve ser encaminhado em sua totalidade ao laboratório. Não é necessário encaminhar esfregaços. O laboratório irá processar a amostra e fará todos os procedimentos necessários (confecções de lâminas citopatológicas, centrifugação e cell block).
- O encaminhamento da amostra deverá ser IMEDIATO. Caso não seja possível encaminhar imediatamente (laboratório fechado, fim de semana, etc.), o líquido puncionado deverar ser colocado em recipiente contendo formol 10% tamponado, com a mesma quantidade do líquido. Por exemplo, se foram coletados 200ml de líquido, o recipiente deverá conter 200ml do seroma + 200ml de formol.
- O pedido médico de encaminhamento deverá conter EXAME CITOLÓGICO e EXAME IMUNOHISTOQUÍMICO, uma vez que a definição da doença depende da pesquisa de linfócitos atípicos CD30+ (vide abaixo).
Uma vez esclarecido esse detalhe técnico, vamos ao tema:
Em 2016 a O.M.S. reconheceu a associação de um tipo especial de linfoma não Hodgkin com o uso de próteses mamárias de silicone, classificando essa lesão como Linfoma Anaplásico de Grandes Células Associado a Implante Mamário (BIA-ALCL – Breast Implant Associated Anaplastic Large Cell Lymphoma) . Essa neoplasia é constituída por uma proliferação de linfócitos T ativados, com expressão de CD30, sendo uma doença potencialmente curável com abordagem cirúrgica exclusiva — se diagnosticada em seus estágios iniciais. O foco deste POST é informar como deve ser feita a investigação diagnóstica laboratorial do BIA-ALCL. Para tanto, precisamos entender como esse linfoma surge, progride e pode ser estudado.
EPIDEMIOLOGIA
A primeira evidência da associação de próteses mamárias com esse linfoma aconteceu em 1997. Desde então, dados cada vez mais robustos mostram que o BIA-ALCL é uma entidade clinico-patológica única que requer abordagens terapêuticas e diagnósticas peculiares. Segundo o FDA, o risco para o desenvolvimento do BIA-ALCL está entre 1 em 3.817 e 1 em 30.000 pacientes com implantes do tipo texturizado.
APRESENTAÇÃO CLÍNICA
A principal apresentação clínica do BIA-ALCL é a formação de uma efusão ao redor do implante. Essa efusão pode aparecer após 1 ano mas ocorre em média de 8 a 10 anos – o assim chamado seroma tardio. “Seroma” é um termo aplicado de forma errada a este quadro. Seromas referem-se a transudados, com baixa contagem celular e baixo conteúdo de proteína. No caso do BIA-ALCL a efusão ao redor do implante contem células linfomatosas necróticas liquefeitas com alto conteúdo protéico. Além dessa apresentação na forma de efusão, em 30% dos casos existe a formação de uma massa tumoral que pode ser palpado pelo paciente. Linfadenopatias podem estar presentes em 20% dos casos, podendo ser de topografia axilar, infraclavicular ou supraclavicular. Seromas tardios são relativamente frequentes em pacientes com prótese, a grande maioria dos casos serão seromas verdadeiros (transudados com baixa contagem celular e baixo conteúdo protéico). Por isso é necessário uma investigação diagnóstica correta para selecionar os casos de BIA-ALCL.
PATOGÊNESE
Por ser uma doença relativamente recente, a patogênese do BIA-ALCL ainda não está completamente elucidada, mas propostas plausíveis foram levantadas. Uma vez que o BIA-ALCL surgiu em tanto pacientes com próteses salinas como em pacientes com próteses de silicone, o fator mais importante na indução da doença seria a superfície da prótese – os casos de BIA-ALCL estão restritos às próteses do tipo texturizadas. A colocação de próteses induziria uma inflamação crônica, essa estimulação antigênica levaria à expansão clonal de células T e eventualmente transformação maligna.
PROGRESSÃO TUMORAL: O BIA-ALCL possui um crescimento escalonado, semelhante a um tumor sólido (Fig 1). Inicialmente existiria a proliferação de células neoplásicas isoladas dentro do líquido peri-prótese. Essa proliferação associada à necrose se manifestaria clinicamente como o “seroma tardio”. A seguir as células neoplásicas adeririam à cápsula podendo infiltrá-la profundamente, alcançando o parênquima mamário. Os próximos estágios seriam o comprometimento de linfonodos e raramente, a disseminação sistêmica da doença.
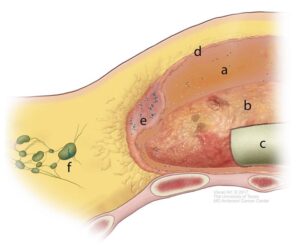
Fig 1 | Hipótese de progressão tumoral, conforme proposto pela equide do MD Anderson. (a) BIA-ALCL surge como células isoladas, ao redor do implante mamário. A manifestação clínica nesse estágio é o acúmulo de uma efusão necrótica (erroneamente chamada de “seroma”) ao redor do implante. (b) Aderência das células neoplásicas na face luminal da cápsula. (c) A superfície texturizada da cápsula geralmente está intacta (não há ruptura) e coberta por uma camada de material fibrino-necrótico. (d) Com a infiltração das células linfomatosas, a cápsula progressivamente torna-se espessa. (e) Formação de uma massa na cápsula que agora pode ser detectada clinicamente ou por exames de imagem. Essa fase indica que as células linfomatosas se extenderam além da cápsula. (f) Em aproximadamente 20% dos casos, o linfoma envolve linfonodos.
Baseado nesse conceito, foi proposto um protocolo de estadiamento, aceito pelo NCCN.
Como pode-se ver, o estadiamento mais frequente é o IA, ou seja, linfoma restrito à efusão ou à face luminal da cápsula. Portanto muito frequentemente esse linfoma não irá se apresentar como uma tumoração discernível clinicamente ou em exames de imagem. Ao contrário, na grande maioria dos casos o linfoma se apresentará na forma “líquida” presente na efusão e/ou em algum foco capsular. Dessa maneira, deve-se buscar o correto manejo do líquido aspirado e da peça cirúrgica para se evitar perdas ou degenerações das amostras diagnósticas.
INVESTIGAÇÃO LABORATORIAL
Uma vez identificado uma paciente com risco clínico de ser portadora de BIA-ALCL, deve-se ser feito estudo radiológico da mama afetada com o seguinte objetivo: 1) Caracrerização da efusão; 2) Guiar a punção aspirativa por agulha fina (PAAF) a fim de obter material para análise (Fig 2).

Fig 2 | Obtenção do líquido peri-protético com PAAF guiado por ultra-som. Em casos de BIA-ALCL a efusão pode ser serosa, viscosa e/ou hemorrágica. O fluido aspirado deve ser encaminhado em sua integralidade e constar de pelo menos 50ml para facilitar o diagnóstico correto.
O diagnóstico de BIA-ALCL é feito com a caracterização de linfócitos morfologicamente atípicos, com expressão de CD30 e negatividade para ALK-1. Para se conseguir avaliar esses critérios, o líquido aspirado deverá ser encaminhado integralmente ao laboratório, dentro da seringa ou de frasco adequado. Deve-se evitar fazer esfregaços diretamente, pois dificultaria a execução de testes complementares indispensáveis para o diagnóstico. Geralmente uma grande quantidade de líquido é aspirada.
No laboratório, esse líquido será processado para confecções de lâminas citológicas que caracterizarão os componentes celulares presentes. A reserva dele poderá ser encaminhada para para realização de citometria de fluxo e/ou confecção de cell blocks (que possibilitarão o exame imunohistoquímico).
Em casos de BIA-ALCL (Fig 3), os esfregaços são hipercelulares, compostos por uma população homogênea de células soltas com escasso citoplasma, núcleos grandes e irregularmente lobulados. O fundo é bem variável e pode conter pequenos linfócitos, neutrófilos, histiócitos e eosinófilos.
Fig 3 | Aspectos citopatológicos do BIA-ALCL. Esfregaço hipercelular constituído por grande população de linfócitos atípicos, discoesos, contendo núcleos irregulares frequentemente hiperlobados.
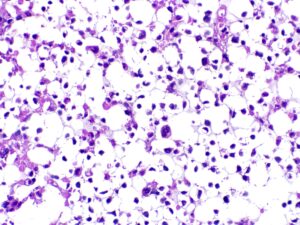
Fig 4 | Corte histológico corado pela H.E. de um cell block com a representação dos linfócitos atípicos. Com o cell block é possível obter cortes para imunohistoquímica, permitindo a caracterização do imunofenótipo dos linfócitos atípicos.
A preparção do cell block auxilia na análise morfológica da efusão e permite que seja executado estudo imunohistoquímico para caracterização imunofenotípica das células atípicas. Os principais marcadores a serem pesquisados nesta etapa consiste no CD30 e ALK-1. Caso os linfócitos atípicos, caracterizados pelo exame citopatológico sejam CD30+ e negativos para ALK-1, confirma-se o diagnóstico de BIA-ALCL (Fig 5). Caso haja co-expressão de ALK-1, a possibilidade de um ALCL sistêmico (não relacionado à prótese mamária) deverá ser investigada. A citometria de fluxo consiste em outra maneira de se caracterizar o imunofenótipo dos linfócitos presentes na efusão (Fig 5).
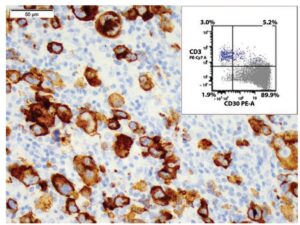
Fig 5 | Imunofenotipagem dos linfócitos atípicos poderá ser feita por imunohistoquímica e/ou citometria de fluxo. Na figura acima observamos corte de BIA-ALCL com expressão de CD30 por imunohistoquímica. No quadro observamos gráfico resultante de citometria de fluxo que caracterizou cerca de 90% das células estudadas como positivas para CD30.
Uma vez diagnosticado BIA-ALCL, o paciente deverá ser estadiado e preparado para a retirada da prótese em bloco (prótese + cápsula). Da mesma maneira que o líquido obtido pela PAAF, a peça cirúrgica deverá ser corretamente abordada. Cabe ao cirurgião enviar o produto da ressecção de maneira íntegra, com identificação das margens cirúrgicas ao laboratório (Fig 6).

Fig 6 | Peça cirúrgica retirada em bloco (cápsula + prótese), contendo marcação das margens cirúrgicas por fios. Peça deverá ser encaminhada íntegra para o laboratório a fim de evitar que a efusão seja perdida.
No laboratório, a superfície da peça cirúrgica será pintada para identificação das margens. A seguir a efusão maligna deverá ser retirada com auxílio de seringa e encaminhado para análise citopatológica (Fig 7). Como já falado aqui, em uma grande proporção de casos, o linfoma estará restrito ao líquido da efusão portanto sua correta manipulação é necessária para resgatar as células diagnósticas desse linfoma.
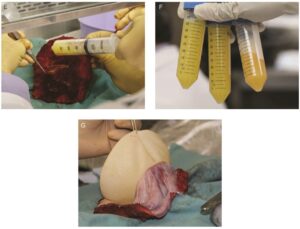
Fig 7 | (E) Avaliação histopatológica da cápsula com retirada do líquido peri-prótese com aspiração por agulha fina . (F) Em casos de BIA-ALCL o líquido costuma ser turvo e viscoso; (F) Neste caso o linfoma estava restrito ao líquido, sem comprometimento da cápsula (estágio 1A).
A apresentação histopatológica do BIA-ALCL reflete os achados citopatológicos. São observado linfócitos grandes, atípicos, com núcleos frequentemente multilobulados. O exame imunohistoquímico revela expressão difusa de CD30 pelos linfócitos atípicos. Importante nessa etapa certificar que além da positividade para CD30 seja caracterizado negatividade para ALK-1, para se excluir a possibilidade de ALCL sistêmico, uma doença mais agressiva.
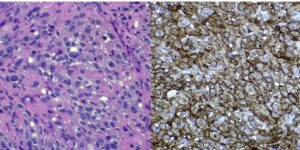
Fig 8 | Corte histológico corado com H.E. mostrando linfócitos grandes, atípicos. Positividade forte e difusa para CD30.
Além da confirmação diagnóstica, o exame anatomopatológico é útil no estadiamento da lesão (Fig 9). Os cortes histológicos irão demonstrar a presença ou não de tumoração além de possibilitar a avaliação da profundidade de invasão ou estruturas comprometidas.

Fig 9 | Estadiamento patológico do BIA-ALCL. (T1) Células neoplásicas confinadas à efusão ou formando uma camada na face luminal da cápsula. (T2) Células neoplásicas infiltram superficialmente a superfície luminal side da cápsula. (T3) Células neoplásicas agregadas infiltram em profundidade a cápsula. (T4) Células neoplásicas infiltram além da cápsula comprometendo tecidos moles ou parênquima mamário.
Como falado anteriormente, em 20% dos casos, o BIA-ALCL poderá comprometer linfonodos. Quando isso ocorre, o envolvimento ocorre em padrão predominantemente sinusoidal mas foram descritos padrões difuso, perifolicular e interfolicular.
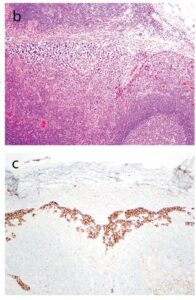
Fig 10 | Cortes histológicos de linfonodo comprometido por BIA-ALCL demonstrando distorção arquitetural em padrão sinusoidal. (c) imunohitoquímica para CD30 acentua a detecção dos linfócitos atípicos nos seios.
Acima demonstramos os achados morfológicos e moleculares do BIA-ALCL tanto no líquido peri-prótese como na cápsula e tecidos adjacentes. Mas como seriam esses achados em pacientes não portadores de BIA-ALCL, ou seja, em pacientes com seromas verdadeiros ? Como falado anteriormente, uma minoria dos casos de “seroma tardio” vão ser causados por BIA-ALCL. É importante conhecermos as alterações induzidas pela prótese mamária para distinguirmos daquelas induzidas pelo BIA-ALCL.
Casos negativos para linfoma apresentam cápsula fibrosa sem irregularidades significantes. A cápsula é fina (<1,0mm) e sua face luminal da é lisa. O exame histopatológico revela células semelhantes a sinóvia (metaplasia sinovial) com discreto infiltrado inflamatório sem células grandes ou atípicas. Se for feito imunohistoquímica para CD30 nesse contexto, poderemos ver raras células isoladas positivas (correspondentes a linfócitos T ativados normais), mas não veremos o padrão de células agrupadas difusamente positivas, como visto no BIA-ALCL. Da mesma maneira, o exame citopatológico de efusões periprótese não linfomatosas serão hipocelulares com presença de raros linfócitos maduros e células espumosas.
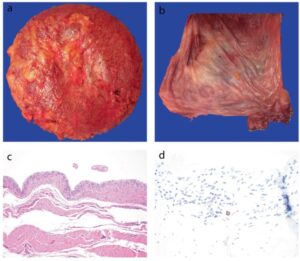
Fig 11 | (a) Ressecção em bloco de implante e cápsula de casos sem envolvimento por linfoma. Não há formação de massas ou irregularidades. (b) Superfície luminal da cápsula é lisa, sem massas ou irregularidades. (c) Revestimento da cápsula possui um aspecto semelhante a sinóvia. (d) Imunohistoquímica para CD30 demonstra expressão negativas pelas células de revestimento com raras células CD30+ no estroma (correspondente a linfócitos T CD30+ ativados, não neoplásicos).
Dr. Marcos Segura
Médico Patologista e Citopatologista com título de especialista nestas duas áreas. Possui mestrado em ciências médicas pela Faculdade de Medicina da UnB. Membro da Academia Internacional de Citologia.
Referências : [1] Quesada AE et al. Breast implant-associated anaplastic large cell lymphoma: a review. Mod Pathol. 2019 32(2): 166-188. [2] Clemens MW, et al. 2019 NCCN Consensus Guidelines on the Diagnosis and Treatment of Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). Aesthet Surg J. 2019. 31:S3-S13. [3] Clemens MW et al. How to Diagnose and Treat Breast Implant-Associated Anaplastic Large Cell Lymphoma. Plas Reconstr Surg. 2018;141(4):586e-599e





Olá,
Tenho prótese de mama a 10 anos e por sentir dores na mama direita, me submeti a uma Ressonância Magnética. No laudo consta seroma. Já decidi que quero explantar em bloco as próteses, mas ainda assim gostaria de saber se antes da cirurgia seria melhor realizar a punção do seroma para investigação?
Atenciosamente,
Jussara, o melhor profissional para responder sua pergunta é seu médico cirurgião. Se houver decisão pela punção do seroma, escolha um laboratório habituado a receber esse tipo de amostra. Espero ter ajudado.
Boa tarde fui diagnosticada BIA-ALCL A DUAS SEMANAS, a 5 anos tive um seroma na mama direita onde minha mama ficou enorme, foi retirada a prótese e todo líquido e colocada outra. a 60 dias senti um caroço na mama direita e comecei a fazer exames e biópsia e PET ,a mama esquerda não foi afetada e continuo com a prótese que coloquei em 2008devo fazer cirugia na próxima semana, o problema tbem apareceu na exila direita, estou super preocupada por ser uma doença nova. Sei q todo material agora vai ser analisado, mais minha indignação for eu ter tido um seroma a 5 anos atrás e não terem feito um acompanhamento e muito menos falado do risco q estava correndo de se tornar um LINFOMA.
Adriana, lamento saber sobre seu caso. O BIA-ALCL é uma entidade caracterizada há pouco tempo, cujas diretrizes de conduta foram estabelecidas só em 2018. Converse com seu médico que terá todas as condições de orientá-la. Obrigado pelo contato.
Adriana, gostaria do seu contato. Gostaria de saber qual foi o procedimento que você fez?
Gostaria de obter teu contato Adriana.
Bom dia acabo de fazer cirurgia para retirada em bloco e o resultado do himunohostoquimico foi
Cd 20 positivo em focos
Cd 3 positivo em focos
Cd 68 positivo em histiocitos
Cd 30 negativo
Vocês conseguem me dizer se isso é positivo? Acabei de receber o resultado.
Aline, como não examinei sua amostra não posso tirar conclusões sobre seu caso específico. Converse com seu médico cirurgião que terá todas as condições de te orientar.
Bom dia. Recebi a biópsia das membranas das próteses mamárias e o meu médico não deu muita importância. Porém gostaria de ter maiores esclarecimentos. Seria possível uma consulta on-line? Agradeceria muito pela atenção.
Cara Raquel, como médico patologista, nossa função é examinar as amostras coletadas pelos demais colegas e fornecer laudos com as nossas conclusões. Caso você tenha alguma dúvida com a conduta que foi tomada, sugiro que procure o profissional responsável para esclarecimentos. Obrigado pelo contato.
Fui diagnosticada com linfoma anaplasico de grandes células T proveniente do implante mamário (BIA-ALCL). Só fazia 4 anos q havia colocado prótese (marca ALLERGAN) e p minha surpresa veio o diagnóstico. Fiz explante mamário, seguido quimioterapia e por fim TRANSPLANTE DE MEDULA ÓSSEA.
Genteeee!!!! Cuidadoooo com o exagero da estética… tenham prudência. A prótese me causou CÂNCER simmmm!!!!!!
Oi Ana Carolina, lamento saber do seu caso, especialmente porque teve que fazer quimioterapia. Por outro lado, ainda bem que você teve seu diagnóstico correto o que possibilitou um tratamento efetivo.
Infelizmente algumas próteses podem sim causar linfoma. Mas você tratou. Boa sorte.
Olá. Tive seroma tardio e ao invés da indicação médica ter sido explante, troquei a prótese de poliuretano por uma lisa, mas ainda assim apresento alguns sintomas da Doença do Silicone. Pesquisando sobre Linfoma Anaplásico de Células Grandes, gostaria de investigar mesmo sem ter seroma atualmente, consigo fazer essa pesquisa pelo método PAAF?
Anne, pelo que você compartilhou não há seroma periprótese. Dessa maneira o risco de ter BIA-ALCL é extremamente baixo. Além disso sem seroma não tem como colher material pela PAAF.
Bom dia! Realizei a Mamotomia no dia 10/06, as amostras foram encaminhadas para este laboratório, com previsão do resultado da análise para o dia 23 de junho de 2022. Peço atenção dessa análise pois eu suspeito deste linfoma, eu fiquei com uma prótese texturizada da Johnson por 9 anos, retirei com a cápsula em novembro de 2018, mas o nódulo surgiu meses antes da retirada do silicone. Gratidão.
Dr Marcos,lendo sua pesquisa vi que o caso é semelhante ao meu. Gostaria de saber aonde o senhor atende para que eu o procure .
Isabella, eu sou patologista. Nossa especialidade trabalha basicamente com exame de amostras biológicas. O melhor profissional para entender sua situação e o contexto clínico será seu cirurgião plástico ou mastologista. Mas estamos a disposição se precisar de mais esclarescimentos.