RELATO DE CASO
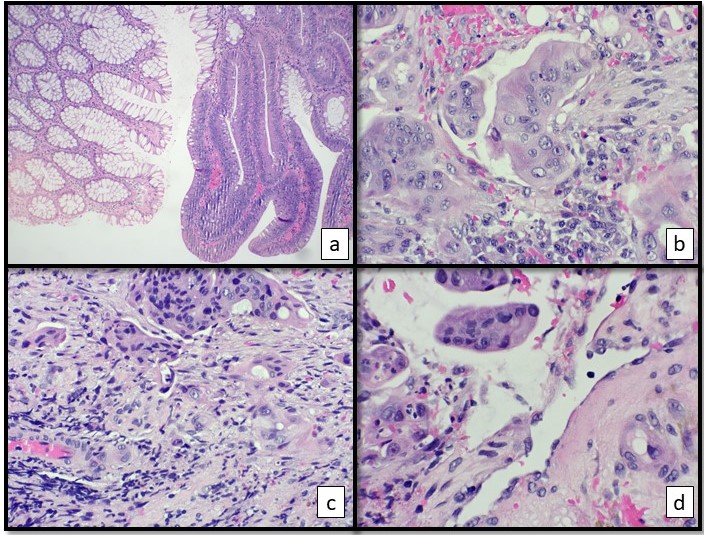
Recebido para exame dois fragmentos de tecido referentes a uma polipectomia de cólon sigmóide de paciente assintomático, na 5a. década de vida. Microscopicamente os fragmentos apresentavam proliferação adenomatosa (adenoma túbulo-viloso com displasia de alto grau) associada a um adenocarcinoma pouco diferenciado (G3) com invasão vascular, perineural e tumor buddings (Figura 1). As margens cirúrgicas não puderam ser avaliadas pois a amostra estava fragmentada.
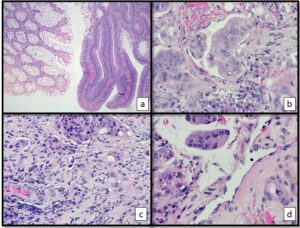
Figura 1. Cortes histológicos do pólipo ressecado. (a) Representação da mucosa normal (esquerda) ao lado da mucosa com displasia de alto grau (direita) ; (b) Adenocarcinoma pouco diferenciado com infiltração perineural; (c) Tumor Budding na frente invasiva do tumor; (d) Presença de êmbolos neoplásicos na luz de pequenos vasos da submucosa do pedículo.
DISCUSSÃO
Alguns casos precoces de carcinoma colorretal (CCR) são identificados em pólipos adenomatosos, esses casos são chamados de “pólipo maligno”, podendo corresponder a até 6% dos pólipos removidos endoscopicamente. Após a remoção de um pólipo maligno, a conduta do paciente deverá considerar dois riscos principais: 1) Potencial de câncer residual na parede intestinal; 2) Possibilidade de neoplasia metastática para os linfonodos regionais. Caso o tumor removido apresente elevado risco para esses dois fatores, um tratamento cirúrgico oncológico complementar deverá ser considerado.
A seguir serão discutidos os fatores de risco a serem analisados em casos de carcinomas surgindo em adenomas intestinais:
Profundidade de Invasão
A profundidade de invasão é avaliada de forma diferente se o pólipo for pediculado ou séssil. Para os pólipos pediculados, a forma mais amplamente aceita é o Sistema de Classificação de Haggitt, que prevê 4 níveis de comprometimento pelo carcinoma:
Nível 1: Carcinoma invadindo a submucosa, limitado à cabeça do pólipo.
Nível 2: Carcinoma invadindo o colo do pólipo (junção da cabeça e pedículo).
Nível 3: Carcinoma invadindo qualquer parte do pedículo.
Nível 4: Carcinoma invadindo a submucosa da parede intestinal, sem comprometer a camada muscular.
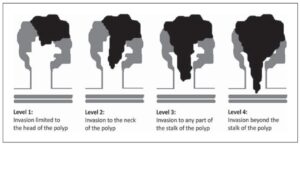
Figura 2. Níveis de Haggitt
Se não houver outras características histológicas desfavoráveis, a incidência de metástase linfonodal é <1% para pólipos completamente removidos com níveis de Haggitt 1,2 ou 3.
Para lesões sésseis, outro método é aplicado, a classificação de Kikuchi. Nessa classificação os níveis de comprometimento pelo carcinoma podem ser divididos em:
sm1: tumor invade o 1/3 superior da submucosa
sm2: tumor invade 1/3 médio da submucosa
sm3: tumor invade 1/3 inferior da submucosa
Existe risco aumentado de metástases linfonodais para os casos sm3 (12-25%) comparados com casos sm1 e sm2 (0-8%). Dessa maneira, as lesões sm1 e sm2 desprovidas de outras características histológicas desfavoráveis podem ser consideradas completamente tratadas com a polipectomia. Em amostras que não contenham a muscular própria, a classificação Kikuchi não poderá ser empregada, nesses casos uma medida direta da profundidade de invasão na submucosa deve ser tentada (caso a muscular da mucosa esteja preservada).
Invasão Linfovascular (LVI)
A presença de LVI é fator de risco para metástases linfonodais (35% de metástases em casos com LVI vs. 7% de metástases em casos sem LVI). Em estudos de meta-análise, LVI se comportou como o mais poderoso preditor de metástases para linfonodos.
Tumor Budding (TB)
Apesar de sofrer com variação na interpretação interobservador, TB se comporta como importante fator de risco para metástases linfonodais em CCR precoce.
Para informações completas sobre TB clique aqui.
Tipo Histológico e Gradação Histológica
Carcinomas pouco diferenciados são identificados histologicamente por um crescimento predominantemente sólido com menos de 50% de formação glandular. Apesar da baixa frequencia (4-7%), os casos de pólipos malignos com alto grau histológico são relacionados a maior risco de doença residual, metástase para linfonodos além de maior mortalidade. Apesar disso, o impacto da gradação histológica na predição de metástases para linfonodos é modesta se comparado com a profundidade de invasão, angioinvasão e tumor budding. Alguns tipos histológicos como o carcinoma com células em anel-de-sinete, são intrisicamente classificados como de alto grau.
Para informações completas sobre tipos histológicos e graduação dos CCR clique aqui.
Margem de ressecção
Espécimes de ressecção endoscópica de pólipos possuem duas margens cirúrgicas para avaliação: 1) Profunda (basal / vertical); 2) Lateral (mucosa). A presença de carcinoma na margem de ressecção (lateral ou profunda) está correlacionada a carcinoma residual. Caso a margem profunda esteja comprometida pelo câncer, considera-se fortemente a possibilidade de uma intervenção cirúrgica. Caso a margem comprometida seja a lateral – esta pode estar comprometida pelo câncer ou pelo adenoma – uma nova biópsia excisional com margens livres poderá ser tentada.
Ainda existe debate em como definir uma margem profunda livre. Alguns estudos mostram que a presença de neoplasia invasiva a menos de 1mm da margem está relacionada a maior taxa de doença residual. Pólipos sésseis possuem maior frequencia de comprometimento de margens.
Estratificação de risco
Após a ressecção endoscópica de um “pólipo maligno”, os fatores de risco para doença residual ou metastase linfonodais devem ser avaliados para se decidir sobre a conduta do paciente. Atualmente, a subdivisão entre grupos de baixo risco e alto risco é baseado em critérios histopatológicos (profundidade de invasão, angioinvasão e margens). Ueno e cols (1) mostraram que o comprometimento linfonodal ocorreu em 0,7% dos casos sem fatores de risco, enquanto aqueles com apenas um fator de risco tiveram metastases em 20,7% e os pacientes com múltiplos fatores de risco tiveram metastases em linfonodos em 36,4% das vezes.
CCR precoce de baixo risco é definido como um tumor completamente excisado, com profundidade de comprometimento em níveis 1 a 3 de Haggit ou sm1 de Kikuchi sem evidencia de adenocarcinoma pouco diferenciado e sem invasão linfática ou vascular. Para esses casos a excisão local com margens livres, seja por polipectomia, ressecção mucosa endoscópica, dissecação submucosa ou cirurgia transanal, é entendida como um tratamento adequado. Espera-se uma frequencia de doença residual de 1,2% e de metastases para linfonodos de 5,1% nessa categoria.
CCR precoce de alto risco é definido como possuidor de pelo menos uma dessas características: Nível Haggitt 4 ou Kikuchi sm3; Presença de invasão linfática ou vascular; Neoplasia pouco diferenciada; Margens comprometidas. Nesses casos é indicado um tratamento cirúrgico oncológico. Na categoria de alto risco, espera-se uma frequencia de 21,4% para doença residual e 11,2% de metastase para linfonodos.
Existe um debate se carcinomas com invasão sm2 devem ser considerados de baixo risco. A decisão dependerá da presença de outros fatores adversos e também nas condições clínicas do paciente para uma indicação cirúrgica.
Parâmetros prognósticos moleculares
A estratificação de risco baseado em critérios anatomopatológicos se provou um método confiável e reprodutível e hoje é usado como padrão para tomada de decisão cirúrgica. Apesar disso, mesmo empregando essa avaliação, a maioria dos pacientes que são classificados como de alto risco e são submetidos a ressecção cirúrgica oncológica não demonstram evidência de metástase linfonodal (em torno de 64% dos casos). Esse cenário estimulou a pesquisa de marcadores moleculares que pudessem contribuir na definição do risco. Esses marcadores podem ser classificados da seguinte maneira: 1) Genes de supressão tumoral e seus produtos (p53, p27); 2) Marcadores com envolvimento na neovascularização (CD34, COX-2, VEGF-C); 3) Marcadores envolvidos na adesão celular e invasão (Ecaderina, CD44v6, beta-Catenina, CITED1). Apesar de resultados promissores, a aplicação de estudos moleculares nesse contexto ainda carece de maior número de amostras para uma conclusão definitiva.
CONCLUSÕES
O caso apresentado ilustra a importância das informações contidas no laudo anatomopatológico para o manejo clínico de pacientes portadores de “pólipos malignos”. Enquanto não são publicados dados mais robustos sobre a aplicação de métodos moleculares na predição de risco, os parâmetros histopatológicos continuam a ser a principal fonte de dados para se indicar uma complementação cirúrgica.
Bibliografia
- Ueno H, Mochizuki H, Hashiguchi Y, et al. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology. 127: 385–394., 2004; .
- Annika Resch, Cord Langner. Risk assessment in early colorectal cancer: histological and molecular markers. Dig Dis. 33(1):77-85, 2015.