O teste de hibridização “in situ” (ISH – “in situ” hibridization) para o gene Her2 é indicado nos casos de carcinoma de mama que demonstraram uma reação duvidosa/equívoca ao exame imunohistoquímico (IHQ 2+). Para essa população, um resultado ISH positivo / amplificado é entendido como um biomarcador preditivo para uma potencial resposta à terapia anti-HER2.
Periodicamente, a Sociedade Americana de Oncologia Clínica (ASCO) e o Colégio Americano de Patologistas (CAP) publicam guidelines sobre a pesquisa do HER2 em câncer de mama. As versões anteriores foram disponibilizadas em 2007 e 2013, sendo a última versão publicada em 20181.
Resumidamente, a técnica de ISH consiste na ligação/hibridização de um DNA marcado (sonda) com os ácidos nucléicos presentes em um tecido, daí o termo hibridização “in situ”. Para revelar essa ligação pode-se usar reveladores fluorecentes (FISH), cromógenos (CISH), prata (SISH) ou dupla marcação cromogênica (DISH). As técnicas que não usam reveladores fluorecentes possuem a vantagem de não precisar de microscópio adapatado e permite arquivamento das lâminas. O guideline ASCO/CAP HER2 2018 admite que podem ser utilizados testes com uma sonda (apenas sonda para HER2) ou duas sondas (sonda para HER2 e o cromossomo 17).
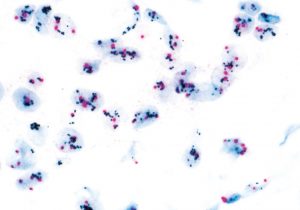
Fig 1| INFORM HER2 DISH (Ventana). O cromossomo 17 é marcado com cromógeno (sinal rosa) e o gene HER2 é marcado com prata (sinal preto). Neste caso observamos vários sinais pretos, inclusive clusters, sendo interpretado como positivo / amplificado.
Quando métodos de duas sondas são usados, deve-se fazer duas contagens: 1) A média do número de sinais do gene HER2 por célula; 2) A média do número de sinais do cromossomo 17 (CEP17) por célula. A partir desses dados será calculada a razão HER2/CEP17. Um caso será considerado positivo se a razão HER2/CEP17 for ≥ 2.0 e o número de cópias do gene HER2 for ≥4.0. Um caso será considerado negativo se a razão HER2/CEP17 for < 2.0 e o número de cópias do gene HER2 for < 4.0.
Aproximadamente 95% dos casos testados irão ser classificados sem dificuldades como positivo / amplificado ou negativo / não amplificado, sendo que os restantes serão considerados como equívocos, necessitando uma investigação mais aprofundada. O GUIDELINE ASCO/CAP HER2 2018 propos uma melhor classificação dos casos equívocos e além de medidas a serm tomadas em cada caso.
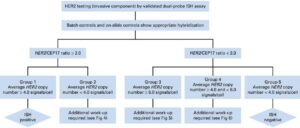
O guideline classificou os resultados possíveis em 5 grupos diagnósticos (ISH GROUPS):
ISH GROUP 1 | HER2/CEP17 ≥ 2.0 e o HER2 > 4.0
Como já escrito, esse grupo é a definição de um caso positivo, ou seja com amplificação do gene HER2, e candidato à terapia.
ISH GROUP 2 | HER2/CEP17 ≥ 2.0 e o HER2 < 4.0
Representa um grupo com amplificação equívoca / duvidosa para o gene HER2, e de baixa incidência. O guideline afirma que existe evidência limitada da eficácia da terapia anti-HER2 nesse grupo. Considerando os ensaios de primeira geração de trastuzumab, as pacientes com essas características não demonstraram melhora na sobrevida livre de doença e sobrevida global. O concenso recomenda executar o teste imunohistoquímico ou re-examiná-lo. Caso a IHQ não seja 3+, o espécime deverá ser considerado negativo para a amplificação até que análise em outra amostra demonstre um resultado inequívoco.
ISH GROUP 3 | HER2/CEP17 < 2.0 e o HER2 ≥ 6.0
Representa um grupo com amplificação equívoca / duvidosa para o gene HER2. Esse grupo apresenta aumento da contagem tanto de sinais para HER2 quanto sinais de Cromossomo 17, resultando em uma baixa razão HER2/CEP17. Engloba uma população heterogênea de tumores, e o concenso considera que nessa população a razão HER2/CEP17 pode não representar o status da amplificação gênica. Como em todos os casos equívocos, uma correlação com o exame imunohistoquímico pode ajudar a definir o status HER2. Se o resultado da IHQ for 3+, o caso deverá ser considerado positivo/amplificado. Se a nova interpretação da IHQ for 1+, o caso deverá ser considerado negativo/não amplificado. Se a nova interpretação da IHQ for 2+, outro observador deverá recontar os sinais do ISH. Mantendo-se HER2/CEP17 < 2.0 e o HER2 ≥ 6.0 no segundo exame ISH, o diagnóstico seria positivo/amplificado.
ISH GROUP 4 | HER2/CEP17 < 2.0 e HER2 ≥ 4.0 e < 6.0
Representa um grupo com amplificação equívoca / duvidosa para o gene HER2. É incerto se pacientes desse grupo se beneficiam com a terapia anti-HER2 na ausência de superexpressão protéica (IHQ 3+). Portanto se o resultado da IHQ não for 3+, é recomendado que a mostra seja considerada negativa / não amplificada.
ISH GROUP 5 | HER2/CEP17 < 2.0 e o HER2 < 4.0
Esse grupo representa os casos negativos / não amplificados que não se beneficiarão com a terapia anti-HER2.
As evidências científicas que embasaram as propostas do guideline foram guiadas por um estudo de 2016 que analisou como os casos equívocos (ISH GROUP 2,3 e 4) se comportaram ao receber terapia anti-HER22.
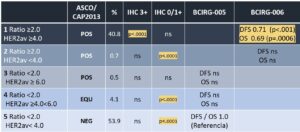
Tabela 1 | Resposta terapêutica dos ISH groups2. ASCO/CAP 2013: Como o guideline classificava o ISH GROUP. %: Proporção de casos. IHC3+: relação do ISH GROUP com IHC3+. IHC 0/1+: relação do ISH GROUP com IHC 0/1+. BCIRG-005: Estudo que analisou a resposta à terapia anti-HER2. BCIRG-006: Estudo que analisou a resposta à terapia anti-HER2. DFS: disease-free survival. OS: Overal survival.
O guideline 2018 trouxe orientações para melhor definir e também reclassificar os casos ISH equívocos (ISH GROUPS 2,3 e 4). Desde sua publicação, alguns estudos analisaram seu impacto na prática clínica. Em resumo, as novas orientações re-classificaram os tumores em 6 a 8% das amostras. A grande maioria (>97%) dos casos antigamente classificados como ambíguos foram re-classificados como negativo / não amplificado2. A falta de evidência científica de que os casos equívocos / duvidosos apresentam resposta clínica à terapia anti-HER2 foi o fator principal para essa re-classificação.
Interessante notar ainda que o GUIDELINE ASCO/CAP HER2 2018 reforçou a importância da IHQ na seleção dos pacientes responsivos à terapia anti-HER2, que hoje é baseada na supressão do receptor localizado na membrana celular, justamente o analito pesquisado com a técnica de imunohistoquímica.
REFERÊNCIAS
[1] Wolff AC et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med. 2018 142(11):1364-1382. [2]Press MF el al. HER2 Gene Amplification Testing by Fluorescent In Situ Hybridization (FISH): Comparison of the ASCO-College of American Pathologists Guidelines With FISH Scores Used for Enrollment in Breast Cancer International Research Group Clinical Trials. J Clin Oncol. 2016 Oct 10;34(29):3518-3528. [3] Liu ZH et al. Impact of the updated 2018 ASCO/CAP guidelines on HER2 FISH testing in invasive breast cancer: a retrospective study of HER2 fish results of 2233 cases. Breast Cancer Res Treat. 2019 May;175(1):51-57.
Dr. Marcos Segura
Médico Patologista e Citopatologista com título de especialista nestas duas áreas. Possui mestrado em ciências médicas pela Faculdade de Medicina da UnB. Membro da Academia Internacional de Citologia.